- 研究确定了激活细胞迁移的“传感器”
- 来源:赛斯维传感器网 发表于 2020/12/1
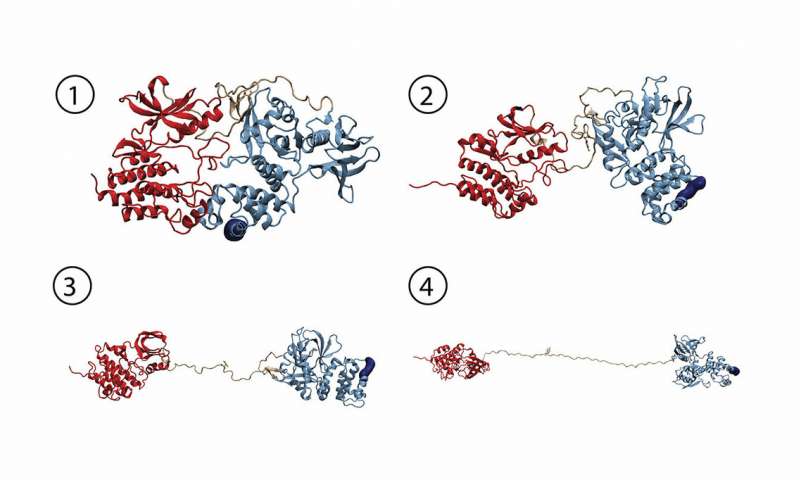
分子动力学模拟提供了力诱导FAK活化的原子细节。从FAK(1)的自抑制构象开始,力诱导一系列变化,从而导致FAK(2-4)完全开放和活跃。
细胞骨架是一种结构,不仅可以帮助细胞维持其形状和内部组织,还可以使它们执行功能,例如向远离其起源的位置移动和迁移。迁移是癌细胞扩散到另一个器官或组织(转移)的重要组成部分。
迄今为止,这种关联还没有被完全理解。细胞骨架产生的机械力如何转化为控制细胞迁移的生化信号?Daniel Lietha在西班牙国家癌症研究中心(CNIO)工作期间,领导了一项国际研究,以回答这个问题。这项发表在《美国国家科学院院刊》(PNAS)上的研究发现,FAK蛋白是一个关键分子,可响应细胞骨架产生的力,激活调节细胞粘附和迁移的生化信号。这些发现拓宽了肿瘤侵袭和转移的知识。
黏着斑激酶(FAK)存在于细胞骨架中,并将细胞锚定在其外部环境的组成部分上。该研究的共同通讯作者Lietha解释说:“这是一种信号分子,是细胞骨架中肌动蛋白丝收缩所产生的力所激活的结构中的关键。” “直到现在,还不清楚FAK是否可以充当细胞运动所需的这些力的传感器。基于FAK是这样的传感器的假设,我们进行了研究。”
研究人员使用原子力光谱法来模拟肌动蛋白丝在细胞骨架中收缩产生的力。他们发现FAK改变了对这些力量的反应。这些变化之一与FAK激活细胞迁移所涉及的生化信号时所采用的形状有关。
原子力光谱技术是一种研究受力下标本行为的技术,包括完整的细胞和单个分子。Lietha说:“实际上,我们使用了LMU的Hermann Gaub团队率先采用的这项技术的特定配置,其灵敏度和精确度可以对单个分子进行高精度的测量。”
由于这项技术,研究人员获得了有关FAK的详细机械信息,再加上其原子结构的知识,可以用力如何诱导结构变化来激活FAK来解释。HITS的分子生物力学小组在高性能计算机上模拟了此过程,以获取这些事件的完整动态视图。小组负责人FraukeGr?ter说:“我们成功地详细揭示了FAK激活的关键步骤。” “我们可以证明这种信号蛋白不仅被力量激活,而且在进一步伸展时仍保持活性。”
细胞的机械环境会影响其行为。粘着斑激酶充当细胞外和细胞内框架变化的传感器。该出版物的第一作者马格努斯·鲍尔(Magnus Bauer)表示:“在单分子原子力显微镜实验和分子导向动力学模拟中,我们观察到了FAK的自抑制复合物的受力介导的打开,进而激活了激酶。”和慕尼黑大学实验方法LMU的Hermann Gaub小组的研究生。
在细胞中,FAK的机械活化是在细胞骨架和细胞外基质之间的压力下触发的。鲍尔说:“使用FAK,似乎我们发现了第一个非肌肉酶是通过机械力直接激活的。” “将我们的数据转移到细胞系统中,我们认为将生理力转化为生化信号可能是触发癌细胞迁移的一种方式。”
这些是将要深入研究肿瘤侵袭和转移的关键发现。Lietha说:“在肿瘤中,基质的硬化导致通过FAK激活信号通路的力增加,从而强烈促进肿瘤的侵袭和转移。” 基质是围绕肿瘤中的癌细胞并影响其进展的组织。了解基质变硬及其在粘附信号激活中的意义与肿瘤浸润的关系可以为针对这种机制的疗法的开发提供基础。
现在已经发现由细胞骨架产生的力促使FAK发生构象变化,需要进一步的研究来测量响应机械力的生化信号。
- 如果本文收录的图片文字侵犯了您的权益,请及时与我们联系,我们将在24内核实删除,谢谢!















